國際權威醫學期刊《柳葉刀-eClinicalMedicine》發表!廣生堂核心蛋白調節劑GST-HG141(奈瑞可韋)II期研究成果獲國際學術界認可
2025年8月3日,福建廣生堂藥業創新藥控股子公司福建廣生中霖生物科技有限公司的國產口服核心蛋白調節劑GST-HG141(英文通用名 “Neracorvir”,中文通用名 “奈瑞可韋”)的II期臨床研究結果正式在線發表于國際頂級醫學期刊《柳葉刀-eClinicalMedicine》。
關于《eClinicalMedicine》
《柳葉刀》是全球四大權威醫學期刊之一。《eClinicalMedicine》是《柳葉刀》旗下發表綜合醫學研究的高端金色開放獲取期刊,屬于綜合醫學領域的權威期刊,是《柳葉刀-開放科學》(The Lancet Discovery Science)的一部分。該期刊是臨床研究中重要早期證據的國際可信來源,有助于研究人員和臨床醫生發現可能改善全世界人們健康和福祉的新機會。《eClinical Medicine》正式刊出GST-HG141的II期臨床研究數據,表明國際學術界對奈瑞可韋療效和安全性的認可。
II期研究展現優異療效與安全性
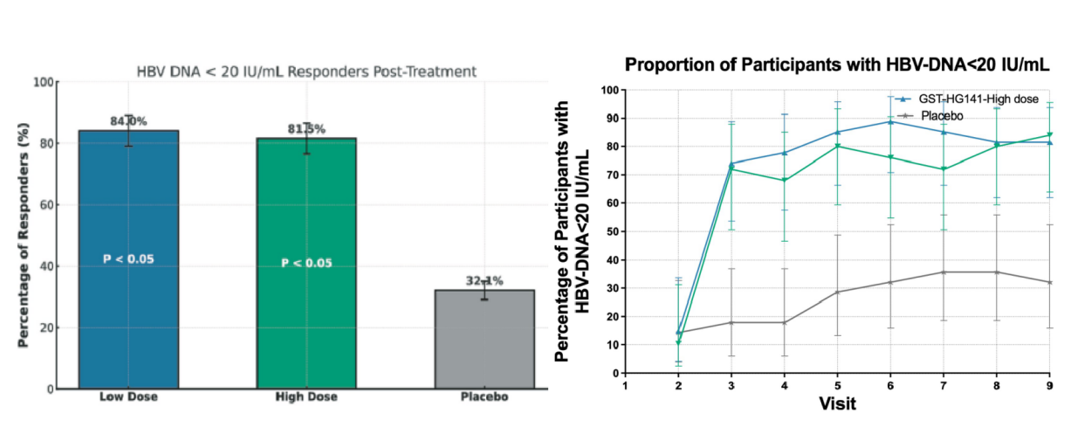
本次發表于《eClinicalMedicine》的研究由吉林大學第一醫院牽頭,聯合南方醫科大學南方醫院、華中科技大學附屬同濟醫院等國內10家臨床中心共同參與,共計90名受試者參加。研究對象為慢性乙型肝炎低病毒血癥(HBV DNA 20~2000 IU/mL)患者。受試者隨機(1:1)接受GST-HG141或安慰劑,每日兩次,連續治療24周,治療期間保持入組前的核苷類似物作為基礎治療。主要療效終點是用藥結束后,血清HBV DNA低于定量檢測值下限(HBV DNA < 20 IU/mL)的受試者百分比。
研究核心發現包括:
顯著抑制HBV DNA: GST-HG141展現出強大的抗病毒活性。治療24周后,低劑量組和高劑量組患者HBV DNA降至檢測下限的比例分別高達84.0%和81.5%,顯著優于安慰劑組(單用核苷(酸)類對照組)的32.1%。藥物起效迅速,治療2周即觀察到HBV DNA載量在核苷類藥物基礎上繼續下降超過1 log10 IU/mL(即降至原水平的1/10以下),且療效持續穩定。
獨特機制靶向pgRNA與cccDNA潛力:GST-HG141作為新型乙肝核心蛋白調節劑,展現出區別于現有核苷類藥物的全新作用機制。研究首次在患者中證實,GST-HG141能顯著降低HBV前基因組RNA(pgRNA)水平(平均下降>1 log10 IU/mL,最大降幅達1.5 log10 IU/mL,即約降至原水平的1/32)。而pgRNA由乙肝病毒共價閉合環狀DNA(cccDNA,病毒持續感染的關鍵)直接轉錄產生。這一結果間接提示GST-HG141具有下調cccDNA轉錄活性甚至潛在耗竭cccDNA的能力,為追求乙肝“臨床治愈”提供了新的科學依據。
良好安全性與耐受性:整個研究期間,未發生任何與GST-HG141相關的嚴重不良事件(SAEs),安全性特征與既往I期研究一致,未發現新的安全性信號,整體安全性良好。
重大意義與未來展望
GST-HG141 II期研究結果在《eClinicalMedicine》的發表,是國際學術界對其創新性、嚴謹性和顯著臨床價值的背書。該研究不僅確證了GST-HG141在LLV這一難治人群中的卓越療效(顯著優于現有標準治療)和良好安全性,更通過降低pgRNA這一關鍵生物標志物,有力支持了其獨特的作用機制——在抑制病毒復制的基礎上,有望觸及cccDNA這一乙肝治愈的“核心堡壘”。
這一突破性進展,為填補LLV患者有效治療的臨床空白帶來了巨大希望。同時,GST-HG141展現出的獨特機制,也使其成為未來與公司另一款在研藥物——表面抗原抑制劑GST-HG131等聯合使用,以追求更高乙肝臨床治愈率的理想候選藥物,為最終實現世界衛生組織(WHO)提出的“消除病毒性肝炎”目標貢獻中國創新力量。2024年11月,GST-HG141的II期臨床研究成果被全球肝病研究領域的權威專業學術機構美國肝病研究協會(AASLD)作為最新突破摘要(Late-breaking Abstract)形式接受并展示。2024年12 月,GST-HG141被國家藥品監督管理局藥品審評中心納入突破性治療品種名單。
目前GST-HG141的 III 期臨床研究已正式啟動,廣生堂藥業將繼續全力推進GST-HG141的后續臨床研究工作,并積極準備向國家藥品監管部門提交溝通申請,力爭早日惠及廣大乙肝患者。
相關新聞
- 1 國際權威醫學期刊《柳葉刀-eClinicalMedicine》發表!廣生堂核心蛋白調節劑GST-HG141(奈瑞可韋)II期研究成果獲國際學術界認可
- 2 甲流癥狀如何緩解,家中常備順氣化痰顆粒
- 3 以堅守鑄就“非凡” ——致敬廣生堂人那些“平凡”的故事
- 4 乘風破浪正當時
- 5 制度發力 中國制藥業送走創新成就最大的一年——2020證券時報藥物創新年度報告
- 6 創新藥三季度報告:創新力量集中于頭部企業,全球首創新藥取得突破,腫瘤藥扎堆存風險
- 7 世界肝炎日|健康中國,廣生堂科普邀您同行
- 8 治愈乙肝全球戰略共識
- 9 “4+7”品種醫保監控大網鋪開
- 10 衛健委出臺"4+7"集采臨床使用配套措施


